
|
 |
|
Revista TriploV
de
Artes, Religiões e Ciências |
| |
|
|
|
|
|
|
 |
|
Carlos A. Filgueiras
(Universidade Federal de Minas Gerais) |
|
|
A EVOLUÇÃO DA QUÍMICA DO SÉCULO
XVI AO SÉCULO XIX
ATRAVÉS DE TEXTOS ORIGINAIS |
|
INDEX |
|
 |
|
CAPÍTULO III: A QUÍMICA NO SÉCULO
XVIII |
|
 |
|
O século XVIII começou com uma química mais amadurecida, distinguindo-se
não só da alquimia moribunda como daquela química totalmente subordinada
à medicina e à farmácia. Aqui já se vê uma ciência da natureza de pleno
direito. Sua melhor expressão foi a formulação da Teoria do Flogisto
pelo químico e médico alemão Georg Ernst Stahl, seguidor de Becher.
Stahl, um médico e professor de medicina, tratava a química como uma
ciência independente, sem nenhuma sujeição à medicina. Ele considerava a
existência de uma distinção fundamental entre a química de laboratório e
aquela que ocorria nos seres vivos. A Teoria do Animismo, mais tarde
denominado Vitalismo, surgiu com ele e durou até o século XIX. Muito já
se escreveu sobre sua teoria mais famosa, a do flogisto, de modo que só
se falará dela aqui de forma breve. A partir do conceito becheriano de
"terra pinguis", ou "terra gorda", um dos componentes dos compostos
químicos, de acordo com Becher, Stahl desenvolveu o conceito de
inflamabilidade, ou "flogisto", do grego, para denominar aquilo que se
desprende quando uma substância arde. A madeira, o azeite, o carvão são
todos materiais ricos em flogisto, pois queimam-se quase totalmente,
restando apenas um pequeno resíduo de cinzas. Os metais também se
"queimam", embora o termo apropriado neste caso seja que eles se
calcinam, originando "cais", aquilo que mais tarde Lavoisier viria a
denominar óxidos. A teoria de Stahl foi a primeira teoria química de
aplicação ampla, capaz de explicar um enorme número de fenômenos. Se um
metal, ao se calcinar, perde flogisto, então se se conseguir devolver
flogisto ao produto da calcinação, a cal, será possível regenerar o
metal original. Esta é a reação de redução, familiar a todos os
metalurgistas. Por exemplo, tanto a cal de ferro ou de estanho, quando
aquecidas com carvão, dão os metais respectivos. Então a teoria de Stahl
era capaz de explicar muitos fenômenos, compreendendo tanto as reações
diretas como as inversas. Por isso ela logrou aos poucos uma enorme
aceitação e dominou toda a química da maior parte do século XVIII, até
ser substituída pela química lavoisiana no último quartel do século. A
Teoria do Flogisto foi publicada por Stahl em várias de suas obras desde
o final do século XVII. Todavia, a versão francesa de seu livro de 1718,
traduzida pelo enciclopedista Barão Dietrich d´Holbach (1723-1789) com o
título de Traité du Soufre, ou Tratado do Enxofre,
publicada em 1766, é considerada por muitos a melhor exposição da Teoria
do Flogisto feita por seu autor. Ele está apresentado aqui na Figura 25. |
 |
Enquanto Stahl desenvolvia
seus trabalhos na Universidade de Halle e mais tarde na Corte de Berlim,
seu contemporâneo Herman Boerhaave (1668-1738) pontificava na
Universidade de Leiden, na Holanda. Também professor de medicina e
química, Boerhaave divergia de seu colega alemão ao defender a
iatrofísica, uma interpretação mecanicista para o funcionamento do corpo
humano, com uma profunda influência de Newton. Todavia, num ponto os
dois convergiam, ao considerarem a química como uma ciência autônoma da
natureza, e não um ramo da medicina. Apresenta-se aqui na Figura 26 a
primeira tradução inglesa da obra de Boerhaave, intitulada A New
Method of Chemistry, publicada em 1727.
|
|
Figura 25. Georg
Ernst Stahl, Traité du Soufre, Paris, 1766 |
|
|
Logo após os primeiros anos
do século XVIII a química passou a ser dominada pelo estudo dos gases,
constituindo a chamada "química pneumática". Foi graças a esses estudos
que a ciência química pôde desenvolver-se e chegar a um estado que
podemos reconhecer como bastante "moderno" nas últimas décadas do
século. |
 |
Um
marco decisivo na química pneumática foi a descoberta, em 1756,
por Joseph Black
(1728-1799), professor de química e medicina na Universidade de
Edimburgo, do ar fixo, que conhecemos como dióxido de carbono.
Black descobriu, ao investigar a magnesia alba, ou carbonato de
magnésio, que ela efervescia ao ser posta em ácidos, e o ar
liberado coincidia com aquele produzido nas fermentações levadas
a cabo nas cervejarias. |
|
Fig.
26. Herman Boerhaave, frontispício de A New Method of
Chemistry, Londres, 1727 |
|
|
Ele mostrou de forma
inequívoca que se tratava de um gás diferente do ar atmosférico
e pela primeira vez ficou demonstrada a existência de um gás
distinto do ar.
O nome ar fixo foi cunhado
por Black em virtude de aquele ar estar fixado num sólido, a
magnesia alba, e poder ser liberado por uma ação química. Com o
decorrer do século XVIII vários outros gases foram descobertos: o ar
inflamável, ou hidrogênio, por Henry Cavendish (1731-1810), em 1766;
o ar mefítico, ou nitrogênio, por Daniel Rutherford (1749-1819),
em 1772; e o ar do fogo, por Carl Wilhelm Scheele (1742-1786), em
1772, chamado em 1774 de ar desflogisticado por Joseph Priestley
(1733-1804), e de ar vital, mais tarde oxigênio, por
Antoine-Laurent Lavoisier (1743-1794), em 1776. Em suma, havia uma
grande atividade em vários países europeus envolvendo o estudo dos
gases.
Uma obra de grande
importância nesse desenvolvimento da química dos gases foi a publicação
de Joseph Priestley (1733-1804) intitulada Experiments and
Observations on Different Kinds of Air, publicada em três volumes em
1777. O químico inglês foi um dos mais notáveis experimentalistas do
século XVIII, tendo-se notabilizado em muitas áreas, sobretudo na
química pneumática. Ele aperfeiçoou os métodos para a obtenção de vários
gases e foi um dos descobridores do oxigênio, como se relatará mais
adiante. Ele o obtinha pela decomposição térmica do óxido de mercúrio,
um método de laboratório muito conhecido até hoje. Um pormenor curioso
da carreira de Priestley foi a reação que ele executou ao fazer dois
gases, a amônia e o cloreto de hidrogênio, passarem por um longo tubo de
vidro, cada gás vindo de uma extremidade. |
 |
Ao se encontrarem no meio do
tubo, os dois gases reagiam, originando um pó branco, o cloreto de amônio. Esta foi a primeira vez que se obteve um sólido diretamente a
partir de dois gases, mostrando de vez por todas que os gases são tão
materiais como os sólidos e os líquidos, ou seja, retirando-lhes
qualquer estatuto particular como se fossem alguma classe especial da
matéria.
Aqui se mostram,
nas Figuras 27 a 30, o frontispício da edição de 1790 do livro de Priestley sobre os gases, juntamente com três das belas pranchas que
ilustram a obra, ilustrações que estão todas agrupadas no volume 1. |
|
Fig. 27. Joseph
Priestley, frontispício de Experiments and Observations on
Different Kinds of Air, Londres, 1790. |
|
|
 |
|
Fig. 28. Priestley, 1790,
vol 1, Prancha I |
|
 |
|
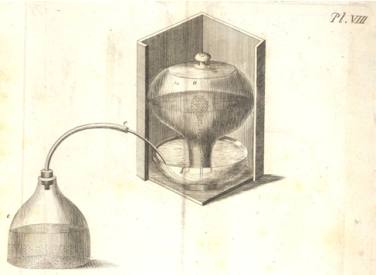
Fig. 29.
Priestley, 1790, vol.1, Prancha II, mostrando parte do laboratório do
químico inglês |
|
 |
|
Fig. 30. Priestley, 1790,
vol.1, Prancha VIII |
|
Como ilustração de que a
química da segunda metade do século XVIII já estava bastante
desenvolvida e bem próxima de nós, até mesmo antes do final da revolução
lavoisiana, mostra-se aqui um livro monográfico sobre o estanho, em que
a química deste elemento é analisada extensamente. O livro, intitulado
Recherches Chimiques sur l´Étain, de autoria de Pierre Bayen
(1725-1798) e Louis Charlard (? - 1798) surgiu de um projeto de pesquisa
encomendado pelo governo francês, que desejava saber se era verdade que
o estanho usado nos utensílios usados à mesa pelos soldados do exército
continha arsênio, como se propalava. Os autores executaram um magnífico
projeto de investigação, que os levou a demonstrar a inexistência de
arsênio no estanho. |
 |
Toda a investigação e seus
resultados foram publicados nesse livro interessantíssimo, cujo
frontispício é dado na Figura 31.
Um importante químico sueco
do século XVIII foi Torbern Olof Bergman (1735-1784). A ele se deve a
distinção das substâncias em orgânicas e inorgânicas. Entre sua vasta
bibliografia, mostra-se aqui a tradução francesa de sua obra intitulada
Manuel du Minéralogiste; ou Sciagraphie du Règne Minéral Distribuée
D`Après L´Analyse Chimique, publicada em 1792, em dois volumes. O
livro trata não apenas de mineralogia, mas é um tratado bastante
abrangente de química inorgânica. |
|
Fig. 31. Bayen e
Charlard, frontispício de Recherches Chimiques sur l´Étain,
de Paris, 1781 |
|
 |
É preciso lembrar que a palavra
fóssil na época designava qualquer mineral existente na terra. Por
isso diz Bergman em seu livro:
"Dá-se o nome de Reino Mineral às
substâncias fósseis que se encontram na terra, que não possuem nenhuma
estrutura orgânica, ou que a tenham perdido, como as petrificações. São
necessários caracteres particulares para reconhecer os fósseis,
distingui-los entre si no espaço e no tempo; e chama-se Mineralogia a
ciência que define seus caracteres."
A Figura 32 mostra
o frontispício do volume 1 da obra de Bergman. |
|
Fig. 32.
Torbern Bergman,
Manuel du Minéralogiste, ou Sciagraphie du Règne Minéral,
Distribuée D`Après L´Analyse Chimique, vol. 1, Paris, 1792 |
|
|
Muito próximo de Bergman
encontramos um outro notável químico sueco, um dos maiores
experimentalistas do século XVIII, Carl Wilhelm Scheele (1742-1784).
Este modesto boticário, lutando a vida inteira com a pobreza que o
assolava, conseguiu, não obstante, construir um edifício magnífico de
realizações científicas de primeira grandeza. Sem mencionar os inúmeros
compostos por ele descobertos, basta apontar sua experiência de 1772, em
que ele descobriu que o dióxido de manganês, ao ser aquecido, libera um
ar, por ele denominado ar do fogo, com propriedades
inusitadas. Este ar fazia com que uma brasa ardesse até
consumir-se completamente e o carvão em pó se inflamasse
espontaneamente. Scheele também produziu o mesmo ar por uma série
de reações químicas, como o aquecimento do óxido de mercúrio, do
carbonato de prata, do nitrato de magnésio e do nitrato de potássio.
Como ele só viria a publicar seus resultados vários anos mais tarde, por
muito tempo não foi considerado o verdadeiro descobridor do oxigênio. |
 |
Em 1774 Priestley obteve o mesmo ar de Scheele e logo publicou seus
resultados, e Lavoisier, a partir de 1776, mostrou o que era aquele novo
gás e sua importância essencial na reação de combustão, assim como
muitas de suas outras propriedades. Por isso, não faz muito sentido opor
os três na busca da paternidade da descoberta do oxigênio, e sim
estabelecer que esta foi uma descoberta conjunta dos três eminentes
químicos. Os experimentos de Scheele foram publicados em 1777, e aqui se
mostra a tradução francesa de seu livro seminal, o Traité Chimique de
L´Air et du Feu, dado à luz em 1781, cujo frontispício está na
Figura 33. |
|
Fig. 33. Carl Wilhelm Scheele, Traité Chimique
de L´Air et du Feu, Paris, 1781; note-se a tradução para o
francês dos prenomes do autor |
|
|
Nas últimas décadas do
século XVIII a química estava portanto em plena efervescência, com uma
plêiade de grandes nomes, alguns deles já abordados aqui, produzindo
trabalhos brilhantes. Destes, o nome mais celebrado é o de Antoine
Laurent Lavoisier (1743-1794), pela abrangência de sua obra e pelo rumo
novo que ele imprimiu à química, assim como por sua enorme influência
sobre o pensamento químico. A mudança na química ao final do século
XVIII, contou com um grande número de protagonistas, mas teve em
Lavoisier seu ator mais destacado. Este fenômeno histórico é conhecido
como Revolução Química. Na verdade ela foi a culminação daquele longo
processo iniciado no século XVI com Paracelso, mas que teve em Lavoisier
seu grande final. O que, pois, constituiu a obra do químico francês?
Como já escrevi em outra ocasião, Lavoisier encarnou o auge de um longo
processo de transformação da química, desde que ela se distanciou da
alquimia, no século XVI, emergindo como uma ciência autônoma, sobre
bases empíricas e racionais, no início do século XVIII. Em que consistiu
esse processo e qual é sua importância? Lavoisier não foi um descobridor
de novas substâncias, o que surpreende muitas pessoas. Ele soube mostrar
como as substâncias interagem, o que é preciso para que as interações
ocorram e o que acontece nessas interações. Ele dotou a química de uma
enorme coerência interna, mostrando que é essencial descrever os
fenômenos não só qualitativamente como quantitativamente. Para isso
tornou-se um mestre nas determinações de massa e de volume. Conseguiu
resolver de uma vez o grande enigma do século XVIII e de todos os
séculos anteriores sobre a natureza da combustão. Mostrou que este
fenômeno está ligado a inúmeros outros de natureza semelhante, como a
oxidação dos metais, a respiração dos animais, a redução dos minérios a
metais, a síntese e a decomposição da água. Estabeleceu uma forma
operacional para o princípio de conservação da matéria e um conceito
moderno de elemento químico, retirando o caráter elementar de misturas
como o ar atmosférico ou de compostos como a água. Foi um pioneiro da
química orgânica, da físico-química e da análise química; criou com
Laplace a calorimetria e delineou alguns aspectos da química biológica.
A ênfase lavoisiana em medir e pesar tudo levou-o a bater de frente com a teoria
stahliana do flogisto, substituíndo-a pela teoria da combustão pelo
oxigênio, que é a nossa teoria atual. De acordo com Stahl, como se viu,
o processo de combustão ou de calcinação consiste na perda de flogisto
pelo corpo que arde ou que se calcina. Enquanto os químicos se
contentassem com explicações qualitativas apenas, a teoria funcionava.
Ora, alguns materiais, como o carvão ou a madeira, ardem com diminuição
de massa, ao passo que o antimônio, o estanho ou o chumbo se calcinam
dando um produto mais pesado. Como conciliar estes dados com a idéia de
que em todos esses casos havia a perda de alguma coisa, o flogisto?
Lavoisier inovou, pois além de levar em conta os aspectos qualitativos,
também pesou meticulosamente todos os reagentes e produtos, fossem eles
sólidos, líquidos ou gases. Assim fazendo, resulta que a combustão ou a
calcinação levam sempre a um aumento de massa. Sua conclusão foi de que
no processo algo se liga quimicamente ao corpo que arde. Suas pesquisas
o levaram a demonstrar que aquilo que se une ao corpo inflamável é o
oxigênio, que representa cerca de 21% do ar atmosférico. Finalmente
estava resolvido o enigma multimilenar da natureza da combustão. |
 |
Lavoisier publicou
dezenas de comunicações nas Memórias da Academia das Ciências de
Paris. Também deu à luz dois livros muito importantes, os Opuscules
Physiques et Chimiques, de 1774, e o Traité Élémentaire de Chimie,
de 1789, este em dois volumes. Ele também foi co-autor, junto com Guyton
de Morveau, Claude Louis Berthollet e Antoine de Fourcroy, do Méthode
de Nomenclature Chimique, publicado em 1787, de que em boa parte
resulta a nomenclatura inorgânica que usamos ainda hoje. A obra dos
quatro químicos franceses buscava estabelecer normas mais gerais e
racionais para uma nomenclatura química sistemática, em substituição à
caótica nomenclatura então usada. Ã Figura 34 mostra
o frontispício do livro com a nova nomenclatura química que se
propunha. |
|
Fig. 34. Morveau,
Lavoisier, Bertholet (sic) e de Fourcroy, Méthode de
Nomenclature Chimique, Paris, 1787 |
|
 |
No século XIX, durante o
Segundo Império, o governo de Napoleão III decidiu honrar a memória
ultrajada de Lavoisier publicando suas obras completas. Isto foi feito
entre 1862 e 1868 sob a supervisão do químico Jean Baptiste Dumas
(1800-1884), resultando em quatro volumes muito bem cuidados e com
ilustrações primorosas, que reeditam os livros e as memórias de
Lavoisier. A estes quatro volumes seguiram-se mais tarde, em 1892-1893,
mais dois volumes, publicados sob a respon-sabilidade de Louis Édouard
Grimaux (1835-1900), historiador da química e biógrafo de Lavoisier.
|
|
Fig. 35. Retrato de Lavoisier, Oeuvres, vol. 1, 1864 |
|
 |
A Figura 35
reproduz a belíssima gravura com o retrato de Lavoisier que abre o
primeiro volume de suas obras completas, conhecidas como Oeuvres.
A Figura 36 reproduz o
frontispíco do primeiro volume das Oeuvres, de 1864. As datas de
publicação não seguem necessariamente a sequên-cia dos volumes. |
|
Fig. 36. Lavoisier, Oeuvres, frontispício do primeiro
volume, que contém o Traité Élémentaire
de Chimie |
|
|
A
seguir serão mostradas mais algumas das excelentes ilustrações
que acompanhavam as edições originais das obras de Lavoisier em
vida e que foram fielmente reproduzidas na edição póstuma do
século XIX.
A Figura 37 consiste no
desenho feito por Madame Lavoisier, ilustradora de todo o Traité
e colaboradora científica do marido, para a Prancha VI do livro, que
reproduz o calorímetro inventado por Lavoisier e Laplace. A Figura 38
mostra um pormenor da mesma figura, com a assinatura da artista,
Marie-Anne Pierrette Paulze Lavoisier. |
|
 |
|
Fig. 37.
Lavoisier, Prancha VI do Traité Élémentaire de Chimie,
como
o calorímetro de Lavoisier e Laplace, desenhado por Mme. Lavoisier, que
assina em baixo, à direita |
|
 |
|
Fig. 38.
Pormenor da Figura 37, mostrando a assinatura de Madame Lavoisier |
|
 |
|
Fig. 39. Lavoisier, Oeuvres,
vol. II, Prancha III, 1862. Reprodução de ilustração da memória de
Lavoisier e Meusnier sobre a decomposição da água, lida na Academia em
1784 e por ela publicada, com o título de Mémoire où on prouve, par la
décomposition de l´eau, que ce fluide n´est point une substance simple,
et qu´il y a plusieurs moyens d´obtenir en grand l´air inflammable qui y
entre comme principe constituant |
 |
|
|
Fig. 40. Lavoisier, Oeuvres, vol.
II, Prancha VII. Ilustração reproduzida da primeira memória de
Lavoisier, premiada e publicada pela Academia em 1765, sobre a
Iluminação de uma grande cidade. Na época ele contava 22 anos de
idade |
|
|
 |
|
41. Lavoisier, Oeuvres, vol. III, 1865,
Prancha IX. Experimentos executados nos anos 1770, com uma enorme lente
convergente para concentrar os raios do sol |
|
 |
|
Fig. 42. Lavoisier, Oeuvres, vol. IV,
Prancha I, 1868. Ilustração da Mémoire sur une nouvelle Méthode
distillatoire appliquée à la distillation des eaux-de-vie et à celle de
l´eau de mer, 1775. Esta ilustração seria utilizada pelo Abbé Rosier em
obra de 1781, a qual foi traduzida no Brasil por José Pinto de Azeredo,
acrescida de muitas notas e publicada por João Manso Pereira na forma do
livro Memória sobre uma Nova Construção do Alambique, Lisboa, 1805 |
 |
Mesmo após a morte
infamante de Lavoisier, a química francesa manteve seu brilho.
Um exemplo disso é o livro em dois volumes de Claude Louis
Berthollet, Essai de Statistique Chimique, de 1803, cujo
frontispício se apresenta na Figura 43. Com esta obra termina
este capítulo relativo à química do século XVIII. Um pormenor
curioso deste frontispício é a existência de duas datas, no
calendário republicano revolucionário francês e no calendário
gregoriano. O calendário revolucionário havia sido adotado no
ano da proclamação da república, 1792, por isso o ano de 1803
vem como ano XI. No ano seguinte Napoleão Bonaparte extinguiria
tanto o calendário republicano como a própria república,
sagrando-se Imperador. |
|
Fig. 43. Claude Louis
Berthollet, Essai de Statique Chimique, Paris, Ano XI - 1803 |
|
|
Engenheiro químico, UFMG (1967), com
doutorado em química, Universidade de Maryland (1972), pós-doutorado
também em química, Universidade de Cambridge (1980-81), estágios curtos
em várias universidades de diversos países. Foi professor titular de
química inorgânica na Universidade Federal de Minas Gerais (1968-1997) e
na Universidade Federal do Rio de Janeiro (1997-2010). Atualmente é
pesquisador da UFMG. Dedica-se á pesquisa em química de coordenação e de
organometálicos, como também ao ensino da química e à pesquisa e
ensino em história da ciência. Tem publicado ao longo desses anos em
todas essas áreas. Foi presidente da Sociedade Brasileira de Química no
biênio 1990-1992.
|
|
|
|